|
Lei n.º 12/2009, de 26 de Março REGIME JURÍDICO DA QUALIDADE E SEGURANÇA RELATIVA AO TRATAMENTO DE TECIDOS E CÉLULAS ORIGEM HUMANA(versão actualizada) |
|
|
Contém as seguintes alterações: |
Ver versões do diploma:
|
|
|
|
|
| SUMÁRIO Estabelece o regime jurídico da qualidade e segurança relativa à dádiva, colheita, análise, processamento, preservação, armazenamento, distribuição e aplicação de tecidos e células de origem humana, transpondo para a ordem jurídica interna as Directivas n.os 2004/23/CE, do Parlamento Europeu e do Conselho, de 31 de Março, 2006/17/CE, da Comissão, de 8 de Fevereiro, e 2006/86/CE, da Comissão, de 24 de Outubro _____________________ |
|
ANEXO VII
Critérios de selecção e análises laboratoriais exigidas a dadores de células reprodutivas |
1 - Tratando-se de dádivas entre parceiros para utilização directa, não é necessário aplicar os critérios de selecção de dadores.
2 - No caso de dádivas entre parceiros para utilização não directa, as células reprodutivas que são processadas ou armazenadas e as células reprodutivas que derem origem à criopreservação de embriões devem respeitar os seguintes critérios:
2.1 - O clínico responsável pelo dador deve determinar e documentar, com base nos antecedentes médicos e nas indicações terapêuticas do paciente, a justificação para a dádiva e a segurança desta para o receptor e para as crianças que puderem vir a nascer;
2.2 - Devem efectuar-se as análises biológicas a seguir indicadas a fim de avaliar o risco de contaminação cruzada:
a) VIH 1 e 2 (anti-HIV-1, 2);
b) Hepatite B (HBsAg; anti-HBc);
c) Hepatite C (anti-HCV-Ab);
2.3 - Caso não estejam disponíveis ou sejam positivos os resultados das análises indicadas no n.º 2.2 ou caso se saiba que o dador constitui fonte de risco de infecção, deve ser concebido um sistema de armazenamento separado;
2.4 - Devem realizar-se análises de anticorpos HTLV I/II em dadores que vivam ou sejam provenientes de zonas com elevada prevalência ou com parceiros sexuais provenientes dessas zonas ou no caso de os pais do dador serem provenientes dessas zonas;
2.5 - Em determinadas circunstâncias, podem ser necessárias análises adicionais, em função dos antecedentes do dador relativamente a viagens e eventual exposição a agentes infecciosos e das características do tecido ou células doadas, tais como RhD, malária, CMV, T. Cruzi;
2.6 - O facto de os resultados serem positivos não é necessariamente impeditivo de dádiva entre parceiros, de harmonia com as legis artis legalmente definidas.
3 - No caso de dádivas não provenientes de parceiros, a utilização de células reprodutivas deve respeitar os seguintes critérios:
3.1 - Os dadores devem ser seleccionados com base na idade, saúde e antecedentes médicos, fornecidos num questionário e mediante entrevista pessoal realizada por médico com experiência. Esta avaliação deve incluir factores relevantes que contribuam para identificar e excluir pessoas cujas dádivas possam apresentar um risco para a saúde de terceiros, como a possibilidade de transmissão de doenças, tais como infecções sexualmente transmitidas, ou para a sua própria saúde, tais como hiperovulação, sedação ou os riscos associados ao procedimento de colheita de óvulos ou às consequências psicológicas de se ser dador;
3.2 - Os dadores devem ser negativos para o HIV-1 e 2, a HCV, HBV e sífilis numa amostra de soro ou plasma, analisada em conformidade com o n.º 1.1 do anexo ii, e os dadores de esperma devem ainda ter negatividade para a Chlamydia numa amostra de urina analisada pela técnica de amplificação de ácidos nucleicos (NAT);
3.3 - Devem realizar-se análises de anticorpos de HTLV I/II em dadores que vivam ou sejam provenientes de zonas com elevada prevalência ou com parceiros sexuais provenientes dessas zonas ou no caso de os pais do dador serem provenientes dessas zonas;
3.4 - Em determinadas circunstâncias, podem ser necessárias análises adicionais, em função dos antecedentes do dador e das características do tecido ou células doadas, tais como RhD, malária, CMV, T. Cruzi;
3.5 - Em relação aos dadores para fins autólogos, é aplicável o disposto no n.º 2.1 do anexo v;
3.6 - Deve proceder-se ao rastreio genético para determinação de genes recessivos autossómicos, que, de acordo com dados científicos internacionais, são prevalecentes nos antecedentes da etnia do dador, e a uma avaliação do risco de transmissão de doenças hereditárias, que se sabe estarem presentes na família, após a obtenção do consentimento. Devem ser prestadas informações completas sobre os riscos associados e sobre as medidas tomadas para a sua atenuação, as quais devem ser comunicadas e claramente explicadas ao receptor.
4 - Requisitos gerais a observar na determinação dos marcadores biológicos:
4.1 - As análises devem ser efectuadas em conformidade com o disposto nos n.os 2.1 e 2.2 do anexo vi;
4.2 - Para dádivas entre não parceiros, devem ser obtidas amostras de sangue no momento de cada dádiva. Para dádivas entre parceiros (não para utilização direta), devem ser obtidas amostras de sangue no prazo de três meses antes da primeira dádiva. Para outras dádivas entre parceiros pelo mesmo dador, devem obter-se novas amostras de sangue de acordo com a legislação nacional, mas num prazo não superior a 24 meses, a contar da obtenção da amostra anterior.
4.3 - As dádivas de esperma não provenientes de parceiros devem ficar em quarentena, no mínimo, durante 180 dias. Após o decurso deste período, devem ser repetidas as análises com nova amostra de sangue.
4.3.1 - Se, num dador, a amostra de dádiva de sangue for analisada também para determinação de HIV, HBV e HCV, pela técnica de amplificação de ácidos nucleicos (NAT), não é necessário testar uma nova amostra de sangue.
4.3.2 - Não é necessário realizar novas análises quando o processamento incluir uma fase de inactivação que tenha sido validada para os vírus em causa. |
Contém as alterações dos seguintes diplomas:
- Lei n.º 1/2015, de 08/01
|
Consultar versões anteriores deste artigo:
-1ª versão: Lei n.º 12/2009, de 26/03
|
|
|
|
ANEXO VIII
Procedimentos de dádiva e colheita de células e tecidos e recepção no banco de tecidos e células |
1 - Procedimentos de dádiva e colheita:
1.1 - Consentimento e identificação do dador:
1.1.1 - Antes de se prosseguir com a colheita de tecidos e células, uma pessoa autorizada deve confirmar e registar:
a) Que o consentimento para a colheita foi obtido em conformidade com o disposto no artigo 24.º da presente lei; e
b) De que forma e por quem o dador foi correctamente avaliado.
1.1.2 - No caso de dadores vivos, o profissional de saúde responsável pela obtenção dos antecedentes de saúde deve assegurar que o dador:
a) Compreendeu a informação prestada;
b) Teve oportunidade de fazer perguntas e que obteve respostas satisfatórias;
c) Confirmou que, tanto quanto lhe é dado saber, todas as informações que prestou são verdadeiras.
1.2 - Avaliação do dador:
1.2.1 - Uma pessoa autorizada deve recolher e registar as informações médicas e comportamentais relevantes do dador, de acordo com os requisitos descritos no n.º 1.4 do presente anexo.
1.2.2 - A fim de obter as informações adequadas, devem utilizar-se diferentes fontes relevantes, incluindo, pelo menos, uma entrevista com o dador, no caso de dadores vivos, e, quando adequado, o seguinte:
a) Os registos médicos do dador;
b) Uma entrevista com uma pessoa que conhecia bem o dador, no caso de dadores cadáveres;
c) Uma entrevista com o médico assistente;
d) Uma entrevista com o médico de clínica geral;
e) O relatório de autópsia.
1.2.3 - No caso de um dador cadáver e, quando tal se justifique, no caso de um dador vivo, deve também fazer-se um exame físico do corpo a fim de detectar quaisquer sinais que possam bastar para excluir o dador ou devam ser avaliados no contexto dos antecedentes médicos e pessoais do dador.
1.2.4 - Todos os registos do dador devem ser analisados e avaliados para determinar da sua adequação e assinados por um profissional de saúde qualificado.
1.2.5 - O disposto nos n.os 1.2 a 1.2.4 do presente anexo não é aplicável a dádivas entre parceiros de células reprodutivas nem a dadores para fins autólogos.
1.3 - Procedimentos de recolha de tecidos e células:
1.3.1 - Devem existir procedimentos de colheita adequados ao tipo de dador e ao tipo de dádiva de tecidos ou células, e que protejam a segurança do dador vivo.
1.3.2 - Os procedimentos de colheita devem conservar as propriedades dos tecidos ou células necessárias para a sua finalidade clínica e simultaneamente reduzir ao mínimo a contaminação microbiológica no decurso deste processo, em especial quando os tecidos e células não puderem subsequentemente ser esterilizados.
1.3.3 - No caso de dádivas provenientes de dadores cadáveres, a zona de acesso deve ser restrita.
1.3.3.1 - Deve usar-se uma zona de trabalho estéril, mediante a utilização de campos esterilizados.
1.3.3.2 - Os profissionais que procedem à colheita devem estar vestidos de forma adequada para o tipo de colheita.
1.3.3.3 - O pessoal deve lavar e esfregar adequadamente as mãos e os braços, usar vestuário e luvas estéreis, viseiras faciais e máscaras de protecção.
1.3.4 - No caso de um dador cadáver, o local de colheita deve ser registado e o período que mediou entre a morte e a colheita deve ser especificado a fim de garantir a conservação das propriedades biológicas e físicas necessárias dos tecidos e células.
1.3.5 - Uma vez colhidos os tecidos e as células do corpo de um dador cadáver, o corpo deve ser reconstituído por forma que a sua aparência seja tanto quanto possível semelhante à sua forma anatómica original.
1.3.6 - Devem ser registadas e examinadas todas as reacções adversas que ocorram durante a colheita e que prejudiquem ou tenham prejudicado um dador vivo, bem como os resultados de investigações destinadas a determinar as causas.
1.3.7 - Devem existir políticas e procedimentos que reduzam ao mínimo o risco de contaminação de tecidos e células por pessoal susceptível de estar infectado com doenças transmissíveis.
1.3.8 - Devem utilizar-se, na colheita de tecidos e células, instrumentos e dispositivos estéreis. Os instrumentos ou os dispositivos devem ser de boa qualidade, validados ou especificamente certificados e sujeitos a manutenção regular para efeitos de colheita de tecidos e células.
1.3.9 - Para instrumentos reutilizáveis, deve existir um procedimento de limpeza e esterilização validado para a remoção de agentes infecciosos.
1.3.10 - Sempre que possível, devem utilizar-se apenas dispositivos médicos com marca CE e todo o pessoal envolvido deve ter recebido formação adequada sobre a utilização desses dispositivos.
1.4 - Documentação relativa ao dador:
1.4.1 - Para cada dador deve existir um registo que contenha os seguintes elementos:
a) Identificação do dador: nome próprio, apelido e data de nascimento. No caso de a dádiva envolver mãe e filho, o nome e a data de nascimento da mãe e o nome, se conhecido, e a data de nascimento do filho;
b) Idade, sexo, antecedentes médicos e comportamentais. A informação recolhida deve ser suficiente para permitir a aplicação dos critérios de exclusão, se necessário;
c) Resultados do exame do corpo, se aplicável;
d) Fórmula de hemodiluição, se aplicável;
e) Formulário de consentimento ou autorização, se aplicável;
f) Dados clínicos, resultados das análises laboratoriais e resultados de outras análises realizadas;
g) Caso se realize uma autópsia, os seus resultados devem ser incluídos no registo. Em relação a tecidos e células que não possam ser armazenados durante períodos prolongados, deve ser gravado um relatório oral preliminar da autópsia;
h) No caso de dadores de células progenitoras hematopoiéticas, a adequação do dador escolhido para o receptor deve ser documentada. Tratando-se de dádivas sem relação de parentesco, quando a organização responsável pela colheita tiver acesso limitado aos dados do receptor, devem ser facultados ao organismo que procede à transplantação os dados do dador que são relevantes para confirmar a adequação.
1.4.2 - O organismo que procede à colheita deve criar um relatório de colheita, que é transmitido ao banco de tecidos e células, dele devendo constar, pelo menos, os seguintes elementos:
a) Identificação, nome e endereço do banco de tecidos e células que vai receber as células ou tecidos;
b) Identificação do dador, incluindo a forma como foi identificado e por quem;
c) Descrição e identificação dos tecidos e células colhidos, incluindo amostras para análise;
d) Identificação da pessoa responsável pela sessão de colheita, incluindo assinatura;
e) Data, hora (quando pertinente, início e fim), local da colheita e procedimento (PON) utilizado, incluindo eventuais incidentes ocorridos; quando necessário, condições ambientais da instalação de colheita (descrição da área física em que se procedeu à colheita);
f) Em relação a dadores cadáveres, as condições em que o cadáver é mantido: refrigerado (ou não), hora do início e do termo da refrigeração;
g) Identificação/números de lote de reagentes e soluções de transporte utilizadas;
h) Quando possível, a data e a hora da morte.
1.4.2.1 - Quando se colher esperma no domicílio, o relatório de colheita deve registar este facto e conter apenas os seguintes elementos:
a) Nome e endereço do banco de tecidos e células que vai receber as células ou tecidos;
b) Identificação do dador e, se possível, a data e hora da colheita.
1.4.3 - Todos os registos devem ser claros e legíveis, protegidos contra alterações proibidas, conservados e prontamente acessíveis nestas condições durante todo o seu período de conservação especificado, em conformidade com o disposto na Lei da Protecção de Dados Pessoais.
1.4.4 - Os registos do dador necessários para garantir uma total rastreabilidade devem ser conservados durante, no mínimo, 30 anos após a utilização clínica, ou data de validade, num arquivo adequado, aceitável pela ASST.
1.5 - Embalagem:
1.5.1 - Após a colheita, todos os tecidos e células colhidos devem ser embalados de forma a reduzir ao mínimo o risco de contaminação e armazenados a temperaturas que preservem as características necessárias e a função biológica das células ou tecidos. A embalagem deve também impedir a contaminação dos responsáveis pelo acondicionamento e transporte de tecidos e células.
1.5.2 - Os tecidos ou células embalados devem ser enviados num contentor adequado para o transporte de materiais biológicos e que mantenha a segurança e a qualidade dos tecidos ou células nele contidos.
1.5.3 - Todas as amostras de tecido ou sangue para análise que os acompanhem devem estar rotuladas com exactidão a fim de assegurar a identificação do dador, devendo incluir o registo da hora e do local em que a amostra foi colhida.
1.6 - Rotulagem dos tecidos ou células colhidos:
1.6.1 - No momento da colheita, cada embalagem que contenha tecidos e células deve ser rotulada.
1.6.2 - O contentor primário de tecidos ou células deve indicar a identificação ou o código da dádiva e o tipo de tecidos e células.
1.6.3 - Quando a dimensão da embalagem o permitir, devem ser fornecidas ainda as seguintes informações:
a) Data da dádiva e, se possível, hora;
b) Advertências de perigo;
c) Natureza de eventuais aditivos (se utilizados);
d) No caso de dádivas para fins autólogos, o rótulo deve indicar «Apenas para utilização autóloga»;
e) Em caso de dádivas directas, o rótulo deve identificar o receptor a que se destinam.
1.6.4 - Caso não seja possível incluir no rótulo da embalagem primária as informações mencionadas nas alíneas a) a e) do número anterior, devem ser fornecidas numa folha separada que acompanha a embalagem primária.
1.7 - Rotulagem do contentor de transporte - se os tecidos ou células forem transportados por um intermediário, os contentores de transporte devem conter nos respectivos rótulos, pelo menos, os seguintes elementos:
a) As menções: «Tecidos e células» e «Manusear com cuidado»;
b) Identificação do estabelecimento a partir do qual a embalagem é transportada (endereço e número de telefone) e o nome da pessoa a contactar em caso de problemas;
c) Identificação do banco de tecidos e células de destino (endereço e número de telefone) e pessoa a contactar para a recepção do contentor;
d) Data e hora do início do transporte;
e) Especificações relativas às condições de transporte que sejam importantes para a qualidade e a segurança dos tecidos e células;
f) No caso de todos os produtos celulares, deve ser incluída a seguinte menção: «Não irradiar»; e
g) Se se souber que um produto é positivo a um marcador de uma doença infecciosa relevante, deve ser incluída a menção: «Perigo biológico»;
h) No caso de dadores para fins autólogos, deve ser incluída a seguinte menção: «Apenas para fins autólogos»;
i) Especificações relativas às condições de armazenamento, tais como: «Não congelar».
2 - Recepção dos tecidos ou células no banco de tecidos e células:
2.1 - Quando os tecidos ou células chegam ao banco de tecidos e células, deve proceder-se à verificação e documentar que a remessa, incluindo as condições de transporte, a embalagem, a rotulagem e a documentação e amostras associadas respeitam os requisitos do presente anexo e as especificações do serviço receptor.
2.2 - Cada banco de tecidos e células deve garantir que os tecidos e as células recebidos sejam colocados em quarentena até serem inspeccionados ou verificados, bem como a respectiva documentação, em conformidade com os requisitos. A análise das informações pertinentes respeitantes ao dador e à colheita e, por conseguinte, à aceitação da dádiva deve ser efectuada por pessoas autorizadas.
2.3 - Cada banco de tecidos e células deve dispor de uma política e de especificações documentadas, que servirão de termo de comparação aquando da verificação de cada remessa de tecidos e células, incluindo amostras. Delas devem constar requisitos técnicos e outros critérios que o banco de tecidos e células considerar essenciais para a manutenção de uma qualidade aceitável.
2.3.1 - O banco de tecidos e células deve dispor de procedimentos documentados para a gestão e a separação de remessas não conformes ou relativamente às quais não se disponha de resultados de análises completos a fim de assegurar a inexistência do risco de contaminar outros tecidos e células que estão a ser processados, preservados ou armazenados.
2.4 - Os dados que devem ser registados no banco de tecidos e células, excepto no caso de dadores de células reprodutivas destinadas a dádivas entre parceiros, incluem os seguintes elementos:
a) Consentimento ou autorização, incluindo as possíveis utilizações dos tecidos e células (como fins terapêuticos ou de investigação, ou ambos) e todas as instruções específicas para eliminação, caso o tecido ou as células não sejam utilizados para os fins relativamente aos quais se obteve o consentimento;
b) Todos os registos exigidos em relação à colheita e aos antecedentes do dador, conforme descrito no n.º 1.4 do presente anexo;
c) Resultados do exame físico, das análises laboratoriais ou outras, tais como o relatório de autópsia, caso tenha sido utilizado em conformidade com o n.º 1.2.2 do presente anexo;
d) No caso de dadores para fins alogénicos, análise correctamente documentada da avaliação completa do dador, em função dos critérios de selecção, por uma pessoa autorizada e formada;
e) No caso de culturas de células destinadas a utilização para fins autólogos, documentação da eventualidade de o receptor ser alérgico a medicamentos.
2.5 - No caso de células reprodutivas destinadas a dádivas entre parceiros, os dados que devem ser registados no banco de tecidos e células incluem os seguintes elementos:
a) Consentimento ou autorização, incluindo as possíveis utilizações dos tecidos e células, tais como para fins reprodutivos apenas ou para fins terapêuticos ou de investigação, e todas as instruções específicas para eliminação, caso o tecido ou as células não sejam utilizados para os fins relativamente aos quais se obteve o consentimento;
b) Identificação e características do dador: tipo de dador, idade, sexo e presença de factores de risco;
c) Identificação do parceiro;
d) Local da colheita;
e) Tecidos e células obtidos e características relevantes. |
| |
|
|
|
|
ANEXO IX
Sistema de biovigilância |
|
ANEXO X
Dados mínimos a conservar em conformidade com o artigo 8.º |
A - Pelas unidades de colheita e bancos de tecidos e células:
Identificação do dador;
Identificação da dádiva que incluirá, pelo menos:
Identificação do organismo de colheita (incluindo os contactos) ou do banco de tecidos e células;
Número único de identificação das dádivas;
Data da colheita;
Local da colheita;
Tipo de dádiva (por exemplo, um tecido ou vários tecidos; autóloga ou alogénica; dadores vivos ou dadores mortos);
Identificação do produto que incluirá, pelo menos:
Identificação do banco de tecidos e células;
Tipo de produto à base de tecidos/células (nomenclatura básica);
Número da pool (se aplicável);
Número do fraccionamento (se aplicável);
Data de validade (se aplicável);
Estatuto dos tecidos ou células (por exemplo, em quarentena, adequadas para utilização, etc.);
Descrição e origem dos produtos, etapas de processamento aplicadas, materiais e aditivos que entraram em contacto com os tecidos e células e que influenciam a sua qualidade e ou segurança;
Código Único Europeu (se aplicável);
Identificação da instalação que emite o rótulo final;
Identificação da aplicação em seres humanos que incluirá, pelo menos:
Data de distribuição ou eliminação;
Identificação do clínico ou utilizador final/instalação.
B - Pelos serviços responsáveis pela aplicação de tecidos e células em seres humanos:
a) Identificação do banco de tecidos e células ou unidades de colheita fornecedoras;
b) Identificação do clínico ou utilizador final/instalação;
c) Tipo de tecidos e células;
d) Identificação do produto;
e) Identificação do receptor;
f) Data da aplicação.
g) Código Único Europeu (se aplicável). |
Contém as alterações dos seguintes diplomas:
- Lei n.º 99/2017, de 25/08
|
Consultar versões anteriores deste artigo:
-1ª versão: Lei n.º 12/2009, de 26/03
|
|
|
|
ANEXO XI
Informação contida no Código Único Europeu |
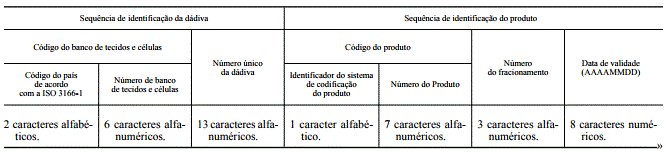
a) Sequência de identificação da dádiva:
i) Código do banco de tecidos e células;
ii) Número único da dádiva;
b) Sequência de identificação do produto:
i) Código do produto;
ii) Número do fracionamento;
iii) Data de validade.
Estrutura do Código Único Europeu
 |
Contém as alterações dos seguintes diplomas:
- Lei n.º 99/2017, de 25/08
|
Consultar versões anteriores deste artigo:
-1ª versão: Lei n.º 12/2009, de 26/03
|
|
|
|
ANEXO XII
Dados a registar no Compêndio dos Bancos de Tecidos e Células da EU |
A - Informação sobre o banco de tecidos e células:
1 - Nome do banco de tecidos e células;
2 - Código nacional ou internacional do banco de tecidos e células;
3 - Nome da instituição em que banco de tecidos e células está localizado (se aplicável);
4 - Endereço do banco de tecidos e células;
5 - Contactos publicáveis: correio eletrónico funcional, telefone e fax;
B - Informação sobre a autorização do banco de tecidos e células:
1 - Nome da(s) autoridade(s) competente(s) de autorização;
2 - Nome da(s) autoridade(s) nacional(ais) competente(s) responsável(eis) pela manutenção do compêndio dos bancos de tecidos e células da UE;
3 - Nome do titular da autorização (se aplicável);
4 - Tecidos e células para os quais foi concedida autorização;
5 - Atividades efetivamente realizadas para as quais foi concedida autorização;
6 - Estado da autorização (concedida, suspensa, revogada, no todo ou em parte, cessação voluntária da atividade);
7 - Detalhes sobre eventuais condições e isenções aditadas à autorização (se aplicável).
|
| |
|
|
|
|
|